实验室制氧气的三种方法及其对应的化学方程式是什么?
在化学实验中,氧气的制备是一个重要的基础操作。本文将详细探讨实验室制氧气的三种主要方法,并给出每种方法对应的化学方程式。通过了解这些方法和方程式,读者可以更好地理解氧气的制备原理及其在化学实验中的应用。

实验室制氧气的三种方法及其化学方程式
在实验室中,制取氧气的方法有多种,其中三种较为常见且有效的方法包括电解水法、过氧化氢分解法和热分解高锰酸钾法。下面将详细介绍每种方法,并给出对应的化学方程式。

一、电解水法
电解水法是通过电解水分子来制取氧气和氢气的方法。这种方法基于水的电解原理,即水分子在电流的作用下分解成氢气和氧气。

原理:
水分子(H₂O)由两个氢原子和一个氧原子组成。在电解过程中,水分子在电解池中的阳极(正极)和阴极(负极)之间受到电流的作用。在阳极,水分子失去电子,形成氧气(O₂);在阴极,水分子得到电子,形成氢气(H₂)。
化学方程式:
电解水的总化学方程式为:
\[2H_2O(l) \rightarrow 2H_2(g) + O_2(g)\]
其中,\(l\)表示液态,\(g\)表示气态。需要注意的是,电解水的过程需要消耗电能,且产生的氧气和氢气体积比为1:2。
实验步骤:
1. 准备一个电解池,加入适量的水。
2. 将电解池的两极插入水中,接通电源。
3. 观察电解现象,收集产生的气体。
4. 通过检验确认气体成分(氧气用带火星的木条检验,氢气用点燃并观察燃烧现象)。
注意事项:
电解水的过程需要纯净的水,以减少杂质对实验结果的影响。
电解过程中会产生一定的热量,因此需要注意散热。
收集气体时,要确保气体收集装置的密封性。
二、过氧化氢分解法
过氧化氢分解法是通过催化剂使过氧化氢(H₂O₂)分解产生氧气的方法。这种方法具有操作简便、反应迅速的优点。
原理:
过氧化氢是一种不稳定的化合物,容易在催化剂的作用下分解产生水和氧气。常用的催化剂有二氧化锰(MnO₂)、红砖粉末、土豆、水泥、铁锈等。
化学方程式:
过氧化氢在二氧化锰催化下的分解反应方程式为:
\[2H_2O_2(l) \overset{MnO_2}{\rightarrow} 2H_2O(l) + O_2(g)\]
其中,\(MnO_2\)表示二氧化锰作为催化剂。
实验步骤:
1. 准备适量的过氧化氢溶液和催化剂(如二氧化锰)。
2. 将催化剂加入过氧化氢溶液中,搅拌均匀。
3. 观察反应现象,收集产生的气体。
4. 通过检验确认气体成分(氧气用带火星的木条检验)。
注意事项:
过氧化氢溶液的浓度会影响反应速率,一般使用较低浓度的过氧化氢溶液。
催化剂的用量也会影响反应速率,但过多的催化剂可能导致反应过于剧烈。
反应过程中可能产生热量,需要注意散热。
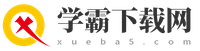
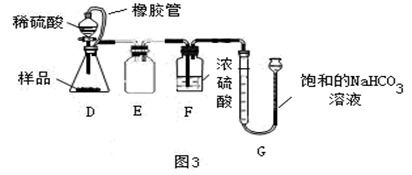
三、热分解高锰酸钾法
热分解高锰酸钾法是通过加热高锰酸钾(KMnO₄)使其分解产生氧气的方法。这种方法适用于需要大量氧气的实验场景。
原理:
高锰酸钾是一种强氧化剂,在加热条件下容易分解产生锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气。
化学方程式:
高锰酸钾的热分解反应方程式为:
\[2KMnO_4(s) \overset{\Delta}{\rightarrow} K_2MnO_4(s) + MnO_2(s) + O_2(g)\]
其中,\(s\)表示固态,\(\Delta\)表示加热。
实验步骤:
1. 准备适量的高锰酸钾固体。
2. 将高锰酸钾放入试管中,用试管夹夹住试管底部。
3. 用酒精灯加热试管底部,使高锰酸钾受热分解。
4. 观察反应现象,收集产生的气体。
5. 通过检验确认气体成分(氧气用带火星的木条检验)。
注意事项:
加热过程中需要控制火候,避免试管破裂或反应过于剧烈。
收集气体时,要确保气体收集装置的密封性。
反应结束后,需要等待试管冷却后再进行处理,以避免烫伤。
总结
本文介绍了实验室制氧气的三种主要方法:电解水法、过氧化氢分解法和
- 上一篇: 鸡眼贴使用到什么程度才算治好?
- 下一篇: 创意无限:为爱犬挑选一个完美名字
-
 实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10
实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10 -
 揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10
揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10 -
 实验室制取氧气的方法与步骤新闻资讯11-09
实验室制取氧气的方法与步骤新闻资讯11-09 -
 求解secx积分的三种常见方法是什么?新闻资讯10-27
求解secx积分的三种常见方法是什么?新闻资讯10-27 -
 苹果手机12的三种截图方法是什么?新闻资讯11-04
苹果手机12的三种截图方法是什么?新闻资讯11-04 -
 过氧化钠与水反应的具体化学方程式新闻资讯11-05
过氧化钠与水反应的具体化学方程式新闻资讯11-05