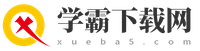
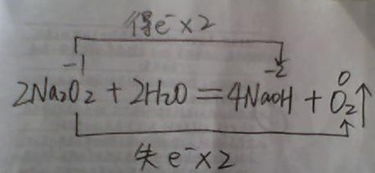过氧化钠与水反应的具体化学方程式
在我们日常生活中,化学反应无处不在,有些反应甚至在我们的厨房或实验室里就能轻松观察到。今天,我们要探讨的是一个引人入胜的化学反应:过氧化钠与水之间的反应。通过这个反应,我们不仅能了解到一个有趣的化学方程式,还能深入理解其背后的化学原理和现象。

首先,让我们从基本的化学物质说起。过氧化钠(Na₂O₂)是一种无机化合物,呈现为米黄色的粉末或颗粒。它与水反应时,会展现出独特的化学特性。
过氧化钠与水的反应
过氧化钠与水反应时,会生成两种产物:氢氧化钠(NaOH)和氧气(O₂)。这个反应是一个典型的氧化还原反应,在这个反应中,过氧化钠既作为氧化剂又作为还原剂。
那么,过氧化钠与水反应的化学方程式是什么呢?它是这样的:
2Na₂O₂ + 2H₂O → 4NaOH + O₂↑
这个方程式告诉我们,每2摩尔的过氧化钠与2摩尔的水反应,会生成4摩尔的氢氧化钠和1摩尔的氧气。这里的氧气以气体的形式从反应体系中逸出,我们用↑符号来表示它。
反应过程与现象
过氧化钠与水的反应不仅是一个简单的化学方程式所能描述的,它背后还隐藏着许多有趣的化学现象。
当我们将过氧化钠加入到水中时,可以看到剧烈的反应发生。过氧化钠与水反应生成氢氧化钠和过氧化氢(H₂O₂)作为中间产物。这个反应是放热的,意味着它会释放出热量。生成的过氧化氢是一种不稳定的化合物,它会在一定的条件下分解,生成水和氧气。
Na₂O₂ + 2H₂O = 2NaOH + H₂O₂
2H₂O₂ = 2H₂O + O₂↑(在加热条件下)
综合这两个反应,我们得到总的反应方程式:
2Na₂O₂ + 2H₂O = 4NaOH + O₂↑
在反应过程中,我们还可以观察到一些有趣的现象。例如,生成的氧气会以气泡的形式从溶液中逸出。这些气泡可以使带火星的木条复燃,这是因为氧气是一种助燃气体。
此外,如果我们向反应后的溶液中滴加酚酞指示剂,溶液会暂时变成红色。然而,很快红色就会褪去。这是因为过氧化钠中的过氧根(O₂²⁻)具有强氧化性,它能够漂白酚酞指示剂,使其颜色褪去。这也是过氧化氢(H₂O₂)漂白作用的一个体现。
化学原理
过氧化钠与水反应的化学原理涉及氧化还原反应和化学键的形成与断裂。
在过氧化钠中,氧原子之间的共价键(O-O键)相对较弱,容易断裂。当过氧化钠与水反应时,水分子的氢原子与过氧化钠中的氧原子形成新的氢氧键(O-H键),同时氧原子之间的共价键断裂,生成过氧化氢。
过氧化氢在反应中起到中间体的作用。它进一步分解生成水和氧气。在这个过程中,过氧化氢中的氧原子之间的共价键断裂,形成新的氧分子(O₂)。
实验安全
虽然过氧化钠与水的反应非常有趣,但在进行实验时,我们必须注意安全问题。
过氧化钠是一种强氧化剂,与水反应时会放出大量的热,并可能引发剧烈的化学反应。因此,在实验过程中,我们应该佩戴适当的防护装备,如实验服、护目镜和手套。此外,实验应在通风良好的环境中进行,以防止氧气积聚引发危险。
实际应用
过氧化钠与水反应不仅在化学实验室中有重要应用,还在工业生产和日常生活中发挥着重要作用。
在工业上,过氧化钠常用于制备氧气。通过过氧化钠与水的反应,可以方便地生成氧气,满足各种工业需求。此外,过氧化钠还可以用于处理废水中的有机物,通过氧化作用将其分解为无害的物质。
在日常生活中,过氧化钠的某些应用可能不那么直接,但它在一些化学制品和清洁剂中作为氧化剂或漂白剂使用,发挥着重要的作用。
深入思考
通过过氧化钠与水反应的实验,我们不仅可以学到一个有趣的化学方程式,还可以对化学反应的实质有更深入的理解。
化学反应不仅仅是元素和化合物之间的简单转换,还涉及到化学键的形成与断裂、能量的释放与吸收以及物质的性质变化。通过观察和分析化学反应,我们可以更好地理解自然界的奥秘和物质世界的运作规律。
此外,这个实验还提醒我们,在进行化学实验时,必须严格遵守安全操作规程。化学反应可能伴随着潜在的危险,因此我们必须时刻保持警惕,确保实验的安全进行。
结语
过氧化钠与水反应是一个充满趣味和教育意义的
- 上一篇: 惠普打印机24小时客服热线,一键速达解决您的打印难题!
- 下一篇: 股票多头、空头及多空策略详解
-
 过氧化钠与水反应:揭秘电子转移的奇妙过程新闻资讯11-06
过氧化钠与水反应:揭秘电子转移的奇妙过程新闻资讯11-06 -
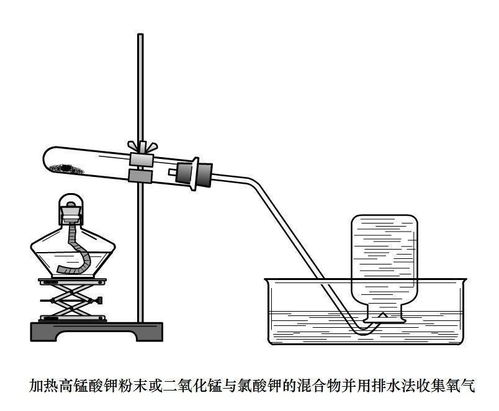 揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10
揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10 -
 如何检验铵根离子?新闻资讯11-02
如何检验铵根离子?新闻资讯11-02 -
 揭秘暖宝宝神奇发热原理新闻资讯11-14
揭秘暖宝宝神奇发热原理新闻资讯11-14 -
 揭秘:氯化钠的化学符号究竟为何?新闻资讯11-03
揭秘:氯化钠的化学符号究竟为何?新闻资讯11-03 -
 揭秘:氯化钠的正确发音,你读对了吗?新闻资讯11-05
揭秘:氯化钠的正确发音,你读对了吗?新闻资讯11-05