揭秘!实验室中三种高效制氧法及其化学反应方程式
在化学实验中,制取氧气是一个基础的且重要的操作。实验室制取氧气的方法有多种,本文将详细介绍三种常见的方法,并给出相应的化学方程式。这些方法包括加热氯酸钾和二氧化锰、加热高锰酸钾、以及利用过氧化氢和二氧化锰进行反应。
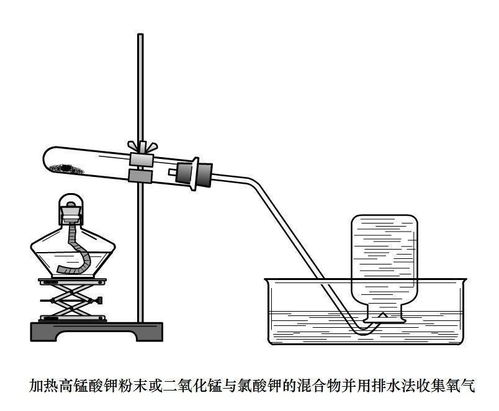
首先,介绍加热氯酸钾和二氧化锰制取氧气的方法。氯酸钾(KClO₃)在二氧化锰(MnO₂)的催化作用下,通过加热可以分解生成氯化钾(KCl)和氧气(O₂)。这个反应的化学方程式为:2KClO₃==(MnO₂,△)2KCl+3O₂↑。在这个方程式中,MnO₂作为催化剂,不参与反应,但能够加速反应进程。△表示反应需要在加热条件下进行,而O₂↑表示氧气是气体产物,应从反应体系中逸出。这种方法的一个优点是氧气利用率高,适用于需要较多氧气的实验。

第二种制取氧气的方法是加热高锰酸钾。高锰酸钾(KMnO₄)在加热的条件下可以分解生成锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气(O₂)。其化学方程式为:2KMnO₄==(△)K₂MnO₄+MnO₂+O₂↑。在这个反应中,加热是唯一的反应条件,不需要催化剂。这种方法的优点是操作简单,且不需要额外的催化剂,降低了实验成本。然而,由于反应过程较为剧烈,需要特别注意实验安全,防止高温产物溅出伤人。
第三种制取氧气的方法是过氧化氢(H₂O₂)在二氧化锰的催化下分解生成水和氧气。这是实验室中制取氧气最常见的方法之一。其化学方程式为:2H₂O₂==(MnO₂)2H₂O+O₂↑。在这个反应中,MnO₂作为催化剂,能够降低反应的活化能,使反应在常温下即可进行。这种方法不需要加热,因此更加环保节能,且操作简便,适合在多种实验条件下使用。
在实验室进行上述三种制氧方法时,需要注意以下几点:
首先,确保实验装置的气密性良好。氧气是一种无色无味的气体,不易溶于水,但在实验过程中,如果装置气密性不佳,氧气可能会泄漏,导致实验失败或结果不准确。因此,在实验前,应对装置进行气密性检查,确保各连接处紧密无漏。
其次,在加热过程中,要注意受热均匀,避免局部过热导致实验失败或安全事故。例如,在加热氯酸钾和二氧化锰时,应使试管略微倾斜,以防止加热时药品所含的少量水分变成水蒸气,在管口处冷凝成水滴而倒流,导致试管破裂。同时,加热过程中应使用适当的热源,如酒精灯或加热板,确保加热均匀且易于控制。
此外,在利用过氧化氢和二氧化锰制氧时,虽然反应在常温下即可进行,但仍需注意观察反应进度,及时调整实验条件。例如,当反应速率过快时,可以通过增加或减少催化剂的量来调节;当反应产物积累过多时,应及时收集并处理,以防止对实验造成干扰。
在实验过程中,还需注意安全防护措施。由于氧气是助燃气体,且实验过程中可能产生高温或有毒气体,因此实验人员应穿戴适当的防护服、手套和护目镜等个人防护装备。同时,实验室内应配备相应的灭火器和急救设备,以应对可能发生的紧急情况。
除了上述三种常见的制氧方法外,还有一些其他方法也可以用于实验室制取氧气。例如,通过电解水可以生成氢气和氧气,但这种方法需要消耗大量电能,且产生的氧气纯度较低,因此在实际应用中较为有限。另外,还有一些化学方法如碳酸钙与盐酸反应等也可以产生氧气,但这些方法通常适用于特定领域或特殊条件下的实验需求。
总的来说,实验室制取氧气的方法多种多样,每种方法都有其独特的优点和适用条件。在选择具体的制氧方法时,需要根据实验需求、实验条件以及安全因素进行综合考虑。同时,在实验过程中要严格遵守操作规程和安全要求,确保实验顺利进行并取得准确可靠的结果。
通过对上述三种常见制氧方法的介绍和分析可以看出,在实验室制取氧气的过程中需要关注多个方面包括实验装置的气密性、加热过程的均匀性、安全防护措施以及实验条件的调整等。只有全面掌握这些要点并认真执行相应的操作规程才能确保实验的顺利进行和结果的准确性。同时随着科学技术的不断进步和发展未来可能会有更多更先进的制氧方法被开发出来为化学实验提供更加便捷和高效的氧气来源。
- 上一篇: 轻松掌握:退货退款一步到位流程
- 下一篇: 掌握电子邮箱格式的正确写法,避免邮件发送失误!
-
 实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09
实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09 -
 实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10
实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10 -
 硝酸钡遇上硫酸,会碰撞出怎样的化学火花?方程式揭秘!新闻资讯12-04
硝酸钡遇上硫酸,会碰撞出怎样的化学火花?方程式揭秘!新闻资讯12-04 -
 过氧化钠与水反应的具体化学方程式新闻资讯11-05
过氧化钠与水反应的具体化学方程式新闻资讯11-05 -
 明矾是如何净水的,其化学方程式是什么?新闻资讯11-09
明矾是如何净水的,其化学方程式是什么?新闻资讯11-09 -
 如何用乙烯合成聚乙烯的化学方程式是什么?新闻资讯12-30
如何用乙烯合成聚乙烯的化学方程式是什么?新闻资讯12-30