实验室制取氧气的方法与步骤
在实验室中制取氧气是一项既有趣又富有教育意义的化学实验。它不仅能够帮助我们理解氧气的性质,还能让我们掌握基本的化学实验技能。下面,我们就来详细探讨一下实验室制取氧气的各个方面。
实验室制取氧气的基本方法
在实验室中,制取氧气通常有以下几种方法:

1. 加热高锰酸钾(KMnO₄)法

2. 热分解氯酸钾(KClO₃)和二氧化锰(MnO₂)混合物法
3. 过氧化氢(H₂O₂)在二氧化锰催化下分解法
1. 加热高锰酸钾法
这种方法是比较常见的一种,它的反应原理是高锰酸钾在加热条件下分解为锰酸钾(K₂MnO₄)、二氧化锰和氧气。具体步骤如下:
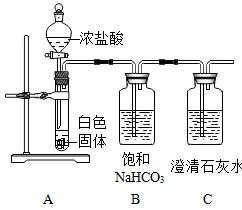
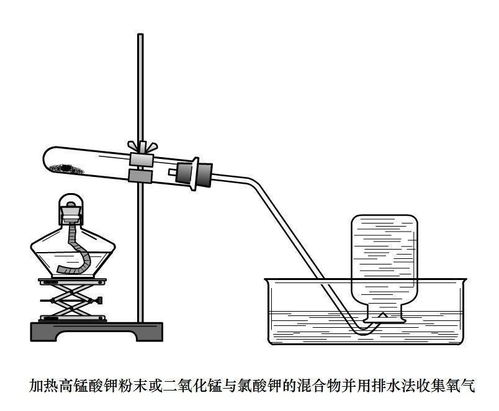
实验准备:准备试管、酒精灯、铁架台、导管、集气瓶、水槽、高锰酸钾晶体等实验器材和药品。
装置装配:将试管水平放置,在离试管口1/3处放入少量高锰酸钾晶体,用干净的镊子将药品平铺在试管底部。试管口微微向下倾斜,以防止冷凝水回流导致试管炸裂。用带导管的单孔橡皮塞塞住试管口,导管另一端伸入水中。
加热操作:点燃酒精灯,先使火焰在试管下方预热,再对高锰酸钾晶体进行均匀加热。
气体收集:当水中的导管有连续均匀的气泡产生时,表示氧气开始生成。此时用集气瓶收集气体,直到集气瓶内充满了氧气。
结束实验:移开酒精灯火焰,让试管自然冷却。在冷却过程中,可以观察到有少量的水进入试管中,这是由于高锰酸钾受热分解产生氧气,使试管内气压高于外界大气压所导致的。冷却至室温后,将试管中的气体导出并收集起来。
2. 热分解氯酸钾和二氧化锰混合物法
这种方法与加热高锰酸钾法类似,但需要注意的是,在试管口不需要塞一小团棉花。具体步骤如下:
实验准备:准备试管、酒精灯、铁架台、导管、集气瓶、水槽、氯酸钾和二氧化锰混合物等实验器材和药品。
装置装配:将试管水平放置,装入适量的氯酸钾和二氧化锰混合物,用带导管的单孔橡皮塞塞住试管口,导管另一端伸入水中。
加热操作:点燃酒精灯,对试管进行加热,注意均匀受热。
气体收集:当水中的导管有连续均匀的气泡产生时,表示氧气开始生成。此时用集气瓶收集气体。
结束实验:移开酒精灯火焰,让试管自然冷却。按照与加热高锰酸钾法相同的步骤处理试管和气体。
3. 过氧化氢在二氧化锰催化下分解法
这种方法以其高效性和便捷性成为许多实验室的首选。具体步骤如下:
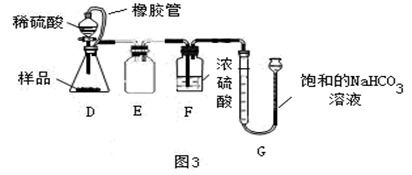
实验准备:准备锥形瓶、分液漏斗、导管、集气瓶、水槽、过氧化氢溶液、二氧化锰粉末等实验器材和药品。
装置装配:将分液漏斗连接到一个带有橡皮塞的锥形瓶上,通过导管将另一端伸入倒置在水槽中的集气瓶中。
加入催化剂:称量适量的二氧化锰粉末,并将其小心地倒入锥形瓶底部。
添加反应物:缓慢滴加一定浓度的过氧化氢溶液至锥形瓶中。
观察现象:随着反应的进行,可以看到大量气泡从液体中逸出,水中溶解的部分氧气会使集气瓶内的水面下降。
气体收集:当集气瓶内充满了气体后,迅速取出并封口,标记为“氧气”。
实验室制取氧气的注意事项
在实验室制取氧气的过程中,有一些注意事项是必须要牢记的:
1. 安全性:操作过程中需佩戴护目镜和手套,以防止化学品伤害。同时,保持通风良好,以防有害气体积聚。
2. 检查气密性:在实验开始前,一定要检查装置的气密性。检查方法是将导管插入水中,用手紧握试管外壁,如果导管口有气泡冒出,证明装置不漏气。
3. 均匀受热:加热试管时,一定要使试管均匀受热,避免局部受热导致试管炸裂。可以先用酒精灯火焰在试管下方预热,再固定加热。
4. 控制反应速率:在添加过氧化氢溶液或加热高锰酸钾时,要控制反应速率,避免剧烈放热导致意外发生。
5. 正确收集气体:收集氧气时,要用排水集气法,因为排水法比排气法收集到的气体的纯度高。同时,要注意及时封住集气瓶口,防止
- 上一篇: 四面体体积计算公式详解
- 下一篇: NFC功能是什么以及如何使用?
-
 实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10
实验室制取氧气的三个核心化学方程式是什么?新闻资讯11-10 -
 实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09
实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09 -
 揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10
揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10 -
 过氧化钠与水反应的具体化学方程式新闻资讯11-05
过氧化钠与水反应的具体化学方程式新闻资讯11-05 -
 揭秘!有效防止铁生锈的绝妙方法新闻资讯11-10
揭秘!有效防止铁生锈的绝妙方法新闻资讯11-10 -
 火灾中致人死亡的主要原因及预防措施是什么?新闻资讯11-06
火灾中致人死亡的主要原因及预防措施是什么?新闻资讯11-06