实验室制取氧气的三个核心化学方程式是什么?
实验室制取氧气的三种化学方程式解析
氧气,作为地球上最常见的元素之一,不仅是维持生命的重要物质,也是实验室中常需制备的气体。在实验室中,制取氧气的方法多种多样,每种方法都基于不同的化学反应原理。本文将重点介绍三种常见的实验室制取氧气的方法,并通过化学方程式进行详细解析。同时,还将从实验步骤、注意事项以及实验背景等多个维度进行阐述,使读者能够全面理解并掌握这些实验方法。
加热高锰酸钾制取氧气
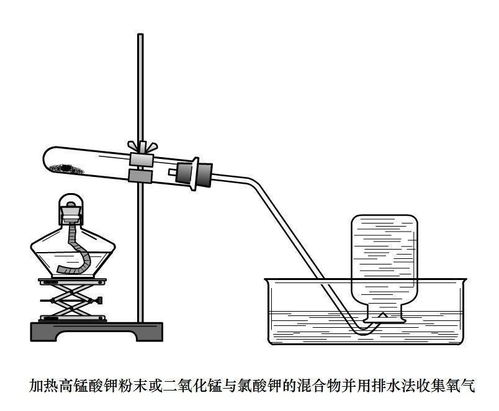
加热高锰酸钾是实验室制取氧气的一种常用方法。高锰酸钾(KMnO₄)在加热条件下会分解生成锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气(O₂)。这一过程的化学方程式为:
\[2KMnO_4 \rightarrow K_2MnO_4 + MnO_2 + O_2↑\]
实验步骤
1. 准备仪器与试剂:试管、铁架台、导管、集气瓶、水槽、高锰酸钾固体。
2. 安装实验装置:将试管固定在铁架台上,试管口略向下倾斜,以防止冷凝水回流炸裂试管。导管一端插入试管内,另一端伸入集气瓶中,集气瓶底部预先放入少量水。
3. 加热高锰酸钾:在试管中加入适量高锰酸钾固体,然后用酒精灯加热试管底部。
4. 收集氧气:当试管内开始有气体产生时,用排水法收集氧气。即当导管口有气泡连续均匀冒出时,开始收集。
5. 停止加热:当集气瓶中氧气收集满后,移出导管,熄灭酒精灯。
注意事项
实验时应佩戴防护眼镜和手套,以防高锰酸钾粉末溅入眼睛或皮肤。
加热时要控制火候,避免试管炸裂。
收集氧气时,要确保导管口始终在集气瓶口上方,以防气体逸出。
加热氯酸钾和二氧化锰制取氧气
氯酸钾(KClO₃)在二氧化锰(MnO₂)的催化作用下,加热分解生成氯化钾(KCl)和氧气(O₂)。这一过程的化学方程式为:
\[2KClO_3 \xrightarrow[MnO_2]{\Delta} 2KCl + 3O_2↑\]
实验步骤
1. 准备仪器与试剂:试管、铁架台、导管、集气瓶、水槽、氯酸钾固体、二氧化锰固体。
2. 混合试剂:将适量氯酸钾和少量二氧化锰混合均匀。
3. 安装实验装置:将混合后的试剂装入试管中,试管口略向下倾斜,安装导管和集气瓶。
4. 加热混合物:用酒精灯加热试管底部,使混合物受热分解。
5. 收集氧气:用排水法收集产生的氧气。
6. 停止加热:当集气瓶中氧气收集满后,移出导管,熄灭酒精灯。
注意事项
二氧化锰作为催化剂,能够降低氯酸钾分解的活化能,从而加速反应速率。
实验过程中要确保试管口始终略向下倾斜,防止冷凝水回流炸裂试管。
收集氧气时,要控制气流速度,确保氧气纯净。
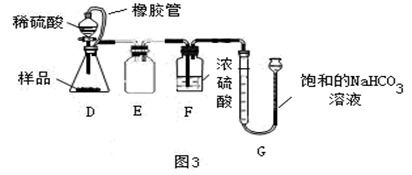
用过氧化氢溶液和二氧化锰制取氧气
过氧化氢(H₂O₂)在二氧化锰的催化作用下可以分解生成水和氧气(O₂)。这一过程的化学方程式为:
\[2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2↑\]
实验步骤
1. 准备仪器与试剂:试管、导管、集气瓶、水槽、过氧化氢溶液、二氧化锰固体。
2. 混合试剂:在试管中加入适量过氧化氢溶液,然后加入少量二氧化锰固体。
3. 安装实验装置:将导管一端插入试管内,另一端伸入集气瓶中,集气瓶底部预先放入少量水。
4. 反应与收集:过氧化氢在二氧化锰的催化作用下迅速分解,产生大量气泡。当导管口有气泡连续均匀冒出时,开始收集氧气。
5. 停止反应:当集气瓶中氧气收集满后,移出导管,将试管中的剩余液体倒入废液缸中。
注意事项
过氧化氢溶液具有氧化性,实验时应避免其直接接触皮肤和眼睛。
二氧化锰作为催化剂,能够显著提高过氧化氢的分解速率。
收集氧气时,要确保导管口始终在集气瓶口上方,以防气体逸出。
实验背景与原理
- 上一篇: TIF格式文件应该用哪个软件打开?
- 下一篇: 七寸照片的尺寸是多少?
-
 实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09
实验室制氧气的三种方法及其对应的化学方程式是什么?新闻资讯11-09 -
 实验室制取氧气的方法与步骤新闻资讯11-09
实验室制取氧气的方法与步骤新闻资讯11-09 -
 揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10
揭秘!实验室中三种高效制氧法及其化学反应方程式新闻资讯11-10 -
 过氧化钠与水反应的具体化学方程式新闻资讯11-05
过氧化钠与水反应的具体化学方程式新闻资讯11-05 -
 揭秘!有效防止铁生锈的绝妙方法新闻资讯11-10
揭秘!有效防止铁生锈的绝妙方法新闻资讯11-10 -
 化学设备气密性检测新闻资讯12-01
化学设备气密性检测新闻资讯12-01