精炼之旅:粗盐提纯的全方位步骤图解
粗盐提纯是一个经典的化学实验,其目的在于通过一系列步骤去除粗盐中的各类杂质,得到较为纯净的精盐。这个过程不仅涵盖了溶解、过滤、蒸发等基本实验操作技能,还涉及了化学反应原理以及实验误差分析。以下是关于粗盐提纯步骤的详细介绍。

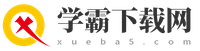
粗盐提纯步骤流程图
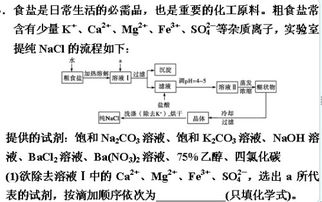
步骤一:溶解

1. 准备工具和原料:粗盐、蒸馏水、烧杯、玻璃棒、托盘天平、量筒、药匙。
2. 称量粗盐:使用托盘天平准确称量一定量的粗盐(如2克,精确到0.1克)。
3. 量取水分:用量筒量取适量的水(如10毫升)倒入烧杯中。
4. 溶解粗盐:将粗盐逐渐加入烧杯中的水中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止。
在这一步中,玻璃棒的搅拌作用主要是加快粗盐的溶解速度。通过这一步,可以大致了解粗盐在水中的溶解度。
步骤二:去除可溶性杂质
粗盐中常见的可溶性杂质包括硫酸盐(如硫酸钠)、氯化镁和氯化钙。这些杂质可以通过加入相应的沉淀剂来去除。
1. 去除硫酸钠:加入过量的氯化钡(BaCl₂),反应生成硫酸钡(BaSO₄)沉淀和氯化钠(NaCl)。
化学反应方程式:BaCl₂ + Na₂SO₄ = BaSO₄↓ + 2NaCl
2. 去除氯化镁:加入过量的氢氧化钠(NaOH),反应生成氢氧化镁(Mg(OH)₂)沉淀和氯化钠。
化学反应方程式:MgCl₂ + 2NaOH = Mg(OH)₂↓ + 2NaCl
3. 去除氯化钙和剩余的氯化钡:加入过量的碳酸钠(Na₂CO₃),反应生成碳酸钙(CaCO₃)沉淀、碳酸钡(BaCO₃)沉淀和氯化钠。
化学反应方程式:
Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl
Na₂CO₃ + BaCl₂ = BaCO₃↓ + 2NaCl
步骤三:过滤
1. 准备过滤装置:将滤纸折叠成圆锥形,放入漏斗中,使滤纸边缘略低于漏斗边缘。
2. 过滤溶液:将溶解并处理后的粗盐溶液沿玻璃棒倒入漏斗中,使液体沿着滤纸流下。
3. 注意事项:
一贴:滤纸与漏斗内壁应紧贴,无气泡。
二低:滤纸边缘低于漏斗边缘,液面低于滤纸边缘。
三靠:烧杯嘴靠在玻璃棒上,玻璃棒下端靠在三层滤纸处,漏斗颈部靠在接收滤液的烧杯内壁上。
如果滤液仍然浑浊,可以重新过滤一次。
步骤四:去除剩余的沉淀剂
1. 加入盐酸:向过滤后的滤液中加入适量的盐酸(HCl),以中和剩余的氢氧化钠和碳酸钠。
化学反应方程式:
NaOH + HCl = NaCl + H₂O
Na₂CO₃ + 2HCl = 2NaCl + CO₂↑ + H₂O
盐酸的用量可以通过pH试纸进行控制,确保没有剩余的沉淀剂。
步骤五:蒸发结晶
1. 准备蒸发装置:将蒸发皿放在铁架台的铁圈上,用酒精灯加热。
2. 倒入滤液:将过滤后的澄清滤液倒入蒸发皿中。
3. 蒸发操作:用酒精灯加热蒸发皿,并用玻璃棒不断搅拌液体,以防止液体飞溅和受热不均。
4. 停止加热:待蒸发皿中出现大量固体时,停止加热,利用蒸发皿的余热将滤液蒸干。
在这一步中,随着加热的进行,蒸发皿中液体的量逐渐减少,直至有固体析出。最终得到的固体即为提纯后的精盐。
步骤六:冷却、称量及计算产率
1. 冷却:待蒸发皿中的固体冷却至室温后,进行称量。
2. 称量:使用托盘天平称量提纯后的精盐质量。
3. 计算产率:根据称量结果,计算精盐的产率。产率的计算公式为:精盐质量 / 粗盐质量 × 100%。
误差分析
在进行粗盐提纯实验时,可能会遇到一些导致误差的因素:
偏低误差:
溶解时将粗盐一次全部倒入水中,立即过滤,导致部分粗盐未溶解。
蒸发时,有液体或固体溅出,导致损失。
固体没有完全被转移到纸上,导致称量结果偏低。
偏高误差:
提纯后的精盐尚未完全干燥就称其质量,导致称量结果偏高。
粗盐中含有其他可溶性固体,导致最终产物质量偏高。
实验注意事项
1. 安全操作:在实验过程中,要注意使用酒精灯的安全操作,避免烫伤。
2. 试剂用量:除了最后的盐酸是适量外,其他的试剂都是过量使用,以确保杂质完全去除。
3. 玻璃棒的作用:玻璃棒在实验过程中多次使用,包括搅拌、蘸水润湿滤纸、引流、搅拌液体防止飞溅以及转移固体等。
4. 实验记录:在进行实验时,要详细记录每一步的操作和观察到的现象,以便进行误差分析和实验总结。
通过粗盐提纯实验,不仅可以掌握溶解、过滤、蒸发等基本实验操作技能,还可以加深对化学反应原理的理解。同时,实验中的误差分析也有助于培养严谨的实验态度和解决问题的能力。
- 上一篇: 掌握火的笔顺,轻松学会书写方法
- 下一篇: CMOS如何正确进行放电?
-
 粗盐提纯的具体步骤是什么?新闻资讯11-08
粗盐提纯的具体步骤是什么?新闻资讯11-08 -
 优化版粗盐提纯操作流程新闻资讯11-08
优化版粗盐提纯操作流程新闻资讯11-08 -
 如何制作高纯度的黄金?新闻资讯12-22
如何制作高纯度的黄金?新闻资讯12-22 -
 如何制作折纸花大全图解?新闻资讯04-16
如何制作折纸花大全图解?新闻资讯04-16 -
 如何详细图解三阶魔方的还原步骤?新闻资讯11-04
如何详细图解三阶魔方的还原步骤?新闻资讯11-04 -
 TP-Link路由器详细设置步骤图解指南新闻资讯11-19
TP-Link路由器详细设置步骤图解指南新闻资讯11-19