粗盐提纯的具体步骤是什么?
粗盐提纯是一个有趣且实用的过程,它不仅能够让我们了解如何从天然资源中提取纯净的盐,还能让我们在操作过程中学习许多化学原理和技术。以下是详细的粗盐提纯步骤,希望能吸引并满足那些对这一领域感兴趣的朋友。
首先,我们需要了解粗盐的基本成分。粗盐主要成分是氯化钠(NaCl),但其中还包含一些不溶性杂质(如泥沙)和可溶性杂质(如氯化镁MgCl₂、氯化钙CaCl₂等)。这些杂质会影响盐的纯净度和质量,因此需要通过提纯过程去除。

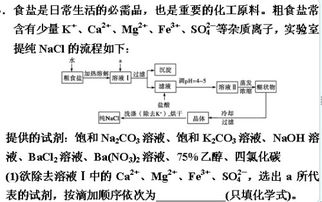
步骤一:粗盐的破碎
提纯的第一步是破碎粗盐。将粗盐放入破碎机中进行处理,使其变为较小的颗粒。这样做可以增大粗盐与溶剂(水)的接触面积,从而提高溶解效率。破碎后的粗盐颗粒应如同碟子大小,便于后续操作。
步骤二:溶解
将破碎后的粗盐加入一个大桶中,并加入适量的水。搅拌并加热这个混合物,使粗盐充分溶解形成盐水。这个步骤在家中也常常见到,例如在制作咸蛋时,需要将粗盐加入水中搅拌,使其溶解成盐水,然后用于浸泡鸭蛋。
步骤三:去除杂质
在溶解后的盐水中,我们需要去除其中的杂质。这些杂质可以通过沉淀或过滤的方式去除。
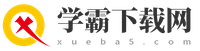
1. 沉淀法:通过加入特定的试剂,使杂质离子以沉淀的形式析出。例如,加入过量的NaOH可以除去MgCl₂,加入过量的Na₂CO₃可以除去CaCl₂和过量的BaCl₂。沉淀形成后,通过过滤将沉淀与溶液分离。
2. 过滤法:将盐水通过过滤纸或过滤装置,将不溶性杂质(如泥沙)过滤掉,留下清亮的溶液。这一步骤在化学实验中非常常见,也类似于在制作豆腐脑时,将豆浆加热后加入熟石膏,然后过滤掉杂质颗粒,使豆腐脑变得幼滑。
步骤四:加入饱和盐水
为了得到纯净的NaCl晶体,我们需要在澄清后的盐水中加入适量的饱和盐水或浓盐水,使其过饱和。这是因为饱和溶液和过饱和溶液之间存在着动态平衡,当溶液达到饱和状态时,继续加入溶质或降低温度,就会使部分溶质析出形成固体。这个过程称为结晶。
步骤五:结晶
在适当的温度下缓慢冷却过饱和盐水,NaCl会以晶体的形式析出。这个步骤可以类比于夏天游泳时,池塘中的水因为热度高、盐分高,在太阳光照射下,盐会结晶出来,形成白色的盐层。
步骤六:分离
将结晶出的盐通过离心、过滤等物理方法分离出来。在某些地方,盐是通过将盐水放在盐田上晾晒,让水分蒸发,然后将结晶出来的盐用工具分离出来。这一步骤是提纯过程中的关键一步,决定了最终得到的盐的纯净度和质量。
步骤七:洗涤
用特定的溶液洗涤过滤后的固体,以去除可能残留的杂质。例如,在提纯过程中加入的NaOH和Na₂CO₃需要通过洗涤去除。这一步确保了最终产品的纯净度。
步骤八:干燥
将洗涤后的湿盐晶体放置在通风干燥的环境中,使其失去水分,变成干盐。这个过程在厨房中也常常见到,例如将腌制好的咸菜放置在通风处晾干,让其失去水分,以便于长期保存。
在提纯过程中,有几个重要的化学原理需要了解:
1. 相同物质在不同温度下的溶解度不同:一般来说,固体物质在高温下溶解度更大,在低温下溶解度更小。因此,在高温下可以溶解更多的粗盐,在低温下可以结晶出更多的纯净的盐。
2. 不同物质在同一温度下的溶解度不同:不同物质之间存在着溶解度差异。例如,在常温下,每100克水可以溶解36克食盐,但只能溶解0.2克碳酸钙。这种差异使得我们可以通过溶解和过滤的方法去除不溶性杂质。
3. 饱和溶液和过饱和溶液的动态平衡:当一个溶液达到了饱和状态时,即无法再溶解更多的溶质时,如果继续向其中加入溶质或降低温度,就会使部分溶质从溶液中析出形成固体。这是结晶过程的基本原理。
除了上述步骤外,提纯过程中还需要注意以下几点:
1. 选择合适的试剂顺序:在提纯过程中,试剂的加入顺序对最终产品的纯净度有很大影响。一般来说,我们首先加入过量的NaOH以去除Mg²⁺,再加入过量的Na₂CO₃以去除Ca²⁺和过量的Ba²⁺,然后加入BaCl₂以去除过量的Na₂CO₃和NaOH,最后加入稀盐酸以调节溶液的pH值并去除可能残留的杂质
- 上一篇: 白求恩一生的光辉事迹概览
- 下一篇: 顺丰快递的投诉电话是多少?
-
 优化版粗盐提纯操作流程新闻资讯11-08
优化版粗盐提纯操作流程新闻资讯11-08 -
 精炼之旅:粗盐提纯的全方位步骤图解新闻资讯11-24
精炼之旅:粗盐提纯的全方位步骤图解新闻资讯11-24 -
 如何制作高纯度的黄金?新闻资讯12-22
如何制作高纯度的黄金?新闻资讯12-22 -
 制作朝鲜风味辣白菜的详细步骤新闻资讯01-17
制作朝鲜风味辣白菜的详细步骤新闻资讯01-17 -
 微信提现的具体步骤是什么?新闻资讯11-23
微信提现的具体步骤是什么?新闻资讯11-23 -
 股票网上开户的具体步骤和流程是什么?新闻资讯06-19
股票网上开户的具体步骤和流程是什么?新闻资讯06-19