一键掌握焓变计算公式
焓变计算公式详解

焓变是化学反应中一个重要的热力学参数,它反映了系统在等压过程中吸收或放出的热量。在化学、物理以及工程领域,焓变的概念都至关重要。为了深入理解焓变,我们需要从焓的定义出发,逐步推导出焓变的计算公式,并探讨其在实际应用中的意义。

一、焓的定义
焓(H)是一个状态函数,它定义为系统的内能(U)与压强(P)和体积(V)的乘积之和,即H=U+PV。焓的物理意义可以理解为在等压条件下,系统发生某一变化时所能吸收或放出的热量。由于焓是状态函数,因此它的值只与系统的始态和终态有关,而与变化的途径无关。
二、焓变的计算公式
1. 基础公式
焓变的计算公式可以表示为ΔH=H(终态)-H(始态),其中ΔH表示焓变,H(终态)和H(始态)分别表示系统终态和始态的焓值。由于焓是内能与压强和体积乘积的和,因此焓变也可以表示为ΔH=ΔU+Δ(PV)。
2. 等压条件下的焓变
在等压条件下,系统的体积会发生变化,从而导致压强与体积乘积的变化。此时,焓变可以进一步表示为ΔH=ΔU+PΔV。由于ΔU表示内能的变化,PΔV表示由于体积变化而吸收的热量(或放出的热量,取决于P和ΔV的符号),因此ΔH就是系统在等压过程中吸收或放出的总热量。
3. 热化学方程式中的焓变
在热化学方程式中,焓变通常表示为ΔH,并标注在方程式的下方。对于放热反应,ΔH为负值;对于吸热反应,ΔH为正值。例如,对于反应A+B→C+D,如果它是放热的,那么热化学方程式可以表示为A+B→C+D ΔH=-x kJ/mol,其中x表示放出的热量。
三、焓变的计算步骤
1. 确定系统的始态和终态
在计算焓变之前,首先需要明确系统的始态和终态。这通常涉及到反应物的种类、数量以及反应条件(如温度、压强)等信息。
2. 计算内能的变化ΔU
内能的变化可以通过热力学第一定律来计算,即ΔU=Q-W,其中Q表示系统吸收的热量,W表示系统对外做的功。在实际应用中,由于内能的变化往往难以直接测量,因此通常需要通过其他途径来间接计算。
3. 计算压强与体积乘积的变化Δ(PV)
在等压条件下,压强是恒定的,因此Δ(PV)就等于PΔV。体积的变化可以通过实验测量或者根据反应方程式来推断。
4. 计算焓变ΔH
最后,将内能的变化ΔU和压强与体积乘积的变化Δ(PV)相加,即可得到焓变ΔH。即ΔH=ΔU+Δ(PV)=ΔU+PΔV。
四、焓变的实际应用
1. 反应热的计算
焓变是计算反应热的重要依据。在化学反应中,反应热通常等于系统的焓变。因此,通过测量或计算焓变,我们可以了解反应是放热的还是吸热的,以及放出或吸收的热量有多少。
2. 燃烧热的测定
燃烧热是指物质完全燃烧时所放出的热量。由于燃烧反应通常是在等压条件下进行的,因此燃烧热就等于燃烧反应的焓变。通过测定燃烧热,我们可以了解不同物质的燃烧性能以及燃烧过程中能量的转化情况。
3. 热力学循环的分析
在热力学循环中,焓变是分析循环效率、能量转化以及热量传递等方面的重要参数。通过计算循环中各个步骤的焓变,我们可以了解循环中能量的流动情况,从而优化循环设计,提高能量利用效率。
4. 化工过程的设计与优化
在化工过程中,焓变是设计和优化过程的重要参数之一。通过计算过程中各个步骤的焓变,我们可以了解过程中能量的消耗和转化情况,从而优化过程设计,减少能量损失,提高生产效率。
五、焓变计算中的注意事项
1. 注意反应条件
在计算焓变时,需要特别注意反应条件。不同的反应条件(如温度、压强)可能会导致不同的焓变值。因此,在计算之前需要明确反应条件,并据此选择合适的计算公式和方法。
2. 注意物质的状态
在计算焓变时,还需要注意物质的状态。不同状态的物质(如固态、液态、气态)具有不同的内能和焓值。因此,在计算之前需要明确物质的状态,并据此选择合适的热力学数据。
3. 注意数据的准确性
在计算焓变时,需要确保所使用的数据是准确的。不准确的数据可能会导致计算结果出现偏差。因此,在计算之前需要对所使用的数据进行仔细核对和验证。
4. 注意单位的一致性
在计算焓变时,需要注意单位的一致性。不同的物理量可能使用不同的单位进行表示(如焦耳、千焦耳、摩尔等)。在计算过程中需要确保所有物理量的单位都是一致的,以避免出现计算错误。
综上所述,焓变是化学反应中一个重要的热力学参数,它反映了系统在等压过程中吸收或放出的热量。通过深入理解焓的定义和计算公式,我们可以更好地理解和应用焓变的概念,从而在实际应用中取得更好的效果。在计算焓变时,需要注意反应条件、物质的状态、数据的准确性以及单位的一致性等方面的问题,以确保计算结果的准确性和可靠性。
- 上一篇: 男生必备!几款超火的碎发发型推荐
- 下一篇: 微信漂流瓶功能使用指南
-
 揭秘梯形面积计算的奥秘:一键掌握高效公式新闻资讯12-22
揭秘梯形面积计算的奥秘:一键掌握高效公式新闻资讯12-22 -
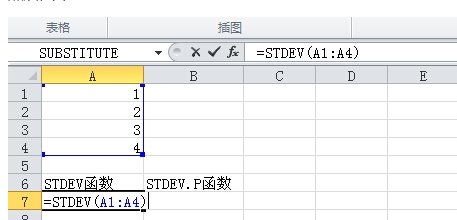 揭秘!你不可不知的标准差计算公式大公开,一键掌握数据分析精髓新闻资讯10-20
揭秘!你不可不知的标准差计算公式大公开,一键掌握数据分析精髓新闻资讯10-20 -
 焓变的准确定义是什么新闻资讯11-13
焓变的准确定义是什么新闻资讯11-13 -
 长方体的体积计算公式是什么?一键揭秘!新闻资讯10-27
长方体的体积计算公式是什么?一键揭秘!新闻资讯10-27 -
 真空度计算公式详解,轻松掌握计算方法!新闻资讯11-12
真空度计算公式详解,轻松掌握计算方法!新闻资讯11-12 -
 精准掌握:相对偏差计算公式的深度解析新闻资讯11-17
精准掌握:相对偏差计算公式的深度解析新闻资讯11-17